Соли. Средние соли | Конспект
Соли:
• Средние (нормальные)
• Кислые: \(\text{NaH}_{2}PO_{4}\) (дигидрофосфат натрия), \(Na_{2}\text{HP}O_{4}\) (гидрофосфат натрия)
• Основные:
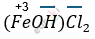 (гидроксохлорид железа (III))
(гидроксохлорид железа (III))
• Комплексные: Na[\({Al(OH)}_{4}\)]
• Двойные: \({KAl(SO}_{4})_{3}\)
• Смешанные: \(\text{CaOCl}_{2}\)
Средние соли
Получение
1. Металл + неметалл = соль
\(2Fe\) + \({3Cl}_{2}\) (\(F_{2},\ \text{Br}_{2}\)) = \({2FeCl}_{3}\)
\(\text{Fe}\) + \(I_{2}\) = \(\text{Fe}I_{2}\)
\(\text{Fe}\) + \(S\) = \(\text{Fe}S\)
\(2Cr\) + \(3S\) = \({Cr_{2}S}_{3}\)
2. Металл (до \(H_{2}\)) + кислота (неокисл.) = соль + \(H_{2} \uparrow\)
\(2\text{HCl}\) + \(\text{Co}\) = \(\text{Co}\text{Cl}_{2}\) + \(H_{2} \uparrow\)
3. Неметалл (Si, P, S) + щёлочь = соль + … (см. в основаниях)
4. Амфотерный элемент + щёлочь.

5. Оксид кислотный + оксид основной = соль.
\(\text{CO}_{2}\) + \(\text{Ba}O\) (сильн.) = \({\text{Ba}\text{CO}}_{3}\)
\(\text{Cu}O\) (слаб.) + \(\text{CO}_{2}\) (слаб.) \(\neq\)
\({Na_{2}O}_{5}\) (сильн.) + \(\text{CuO}\) = \({Cu(NO}_{3})_{2}\)
6. Кислотный оксид + щёлочь = соль + \(H_{2}O\).
\({\text{Si}O}_{2}\) + \(2N\text{aO}H\) → \({Na_{2}\text{Si}O}_{3}\) + \(H_{2}O\)
7. Основной оксид + кислота = соль + \(H_{2}O\).
\(\text{CuO}\) + \({H_{2}SO}_{4}\) = \({\text{Cu}_{2}SO}_{4}\) + \(H_{2}O\)
8. Кислота + основание = соль + \(H_{2}O\). Реакция нейтрализации.
\(2HCl\) + \({\text{Fe}(OH)}_{2}\) = \(\text{FeCl}_{2}\) + \({2H}_{2}O\)
Химические свойства средних солей
1. Кислота1 + соль2 = кислота2 + соль1 (↓)
\(2HCl\) + \({\text{Ca}CO}_{3}\) = \({\text{Ca}\text{Cl}}_{2}\) + \({CO}_{2}\) + \(H_{2}O\)
2. Щёлочь + соль1 = соль2 + основание1 ↓
\(2\text{NaO}H\) + \({Cu(NO}_{3})_{2}\) = \({Cu\left( \text{OH} \right)}_{2} \downarrow\) + \({2NaNO}_{3}\)
3. Соль1 + соль2 = соль3 + соль4 ↓
Условия:
1) соль1 и соль2 – растворимы;
2) образование осадка в продуктах реакции.
\({B\text{aCl}}_{2}\) (р.) + \({K_{2}SO}_{4}\) (р.) = \(2K\text{Cl}\) + \({\text{Ba}\text{SO}}_{4} \downarrow\) (белый)
4. Соль + осадок \(\neq\)
Соль + оксид \(\neq\)
Но!
Сплавление карбонатов и сульфитов с амфотерными оксидами с заменой кислотного остатка.
\({\text{Na}_{2}CO}_{3}\) + \({\text{Fe}_{2}O}_{3}\) (\({H\text{FeO}}_{2}\)) → \({2Na\text{Fe}O}_{2}\) + \(\text{CO}_{2} \uparrow\)
5. Реакция растворимых силикатов с \(\text{CO}_{2}\) или \({SO}_{2}\)
\({\text{Na}_{2}\text{Si}O}_{3}\) +\({\ 2\text{CO}}_{2}\) + \(2H_{2}\text{O\ }\)→ \({2Na\text{HC}O}_{3}\) + \({H_{2}\text{Si}O}_{3} \downarrow\)
6. Сплавление карбонатов и сульфитов с \({SiO}_{2}\)
\({\text{Na}_{2}CO}_{3}\) +\({\ \text{Si}O}_{2}\ \)→ \({Na_{2}\text{Si}O}_{3}\) + \({CO}_{2} \uparrow\)
7. Разложение солей аммония.
Если кислотный остаток в составе соли не обладает выраженной окислительной способностью, то разложение идёт с выделением \({\ \text{NH}}_{3}\).
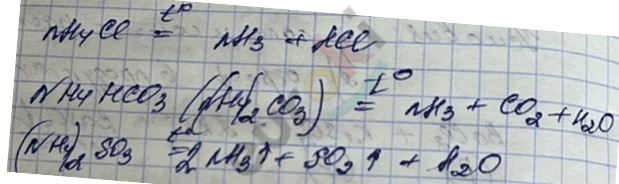
Если кислотный остаток с выраженной окислительной способностью, то \(\text{\ NH}_{3}\) не выделяется.
\({{NH}_{4}NO}_{2}\) \(\)→ \({2H}_{2}O\) + \(N_{2} \uparrow\)
\({\text{NH}_{4}NO}_{3}\) \(\)→ \({2H}_{2}O\) + \(N_{2}O \uparrow\)
\(({\text{NH}_{4})_{2}Cr_{2}O}_{7}\) \(\)→ \(N_{2}\) + \(\text{Cr}_{2}O_{3}\) + \({4H}_{2}O\)


