Алканы | Конспект
Особенности строения алканов
1) Гибридизация – это выравнивание электронных орбиталей по форме и энергии.

2) Форма молекулы CH4 или пространственное расположение каждого атома С в молях алкана в виде тетраэдра.
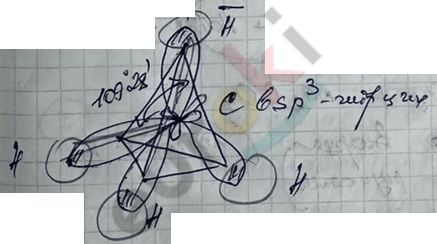
3) Валентный угол – угол между гибридными электронными орбитами, равный 109°28'.
4) \(l_{C - C\ }\sim\) 0,154 нм
5) Тип связи: все связи \(\sigma\)-типа.
Физические свойства алканов
\(С_{1} - С_{4}\) – газы, без цвета, без запаха, не растворяются в воде.
\(С_{5} - С_{15}\) – жидкости
\(С_{16}\) – твёрдые вещества
Получение алканов
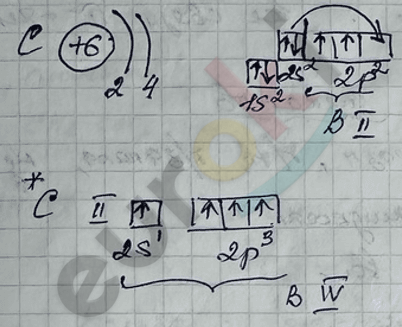
1) Карбидный метод

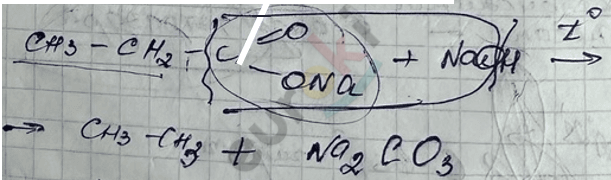
2) Реакция декарбоксилирования – сплавление солей карбоновых кислот со щелочами.
3) Реакция Вюрца – приводит к удвоению радикала.
а) «простой»

б) «сложный»
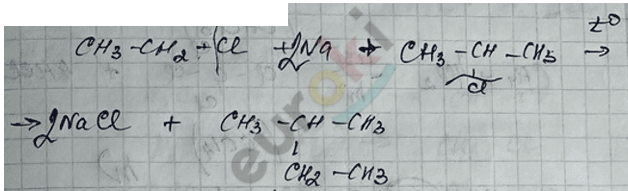
4) Реакция Кольбе – электролиз растворов солей карбоновых кислот.
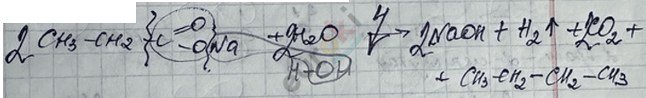
5) Реакция гидрирования непредельных УВ-веществ.
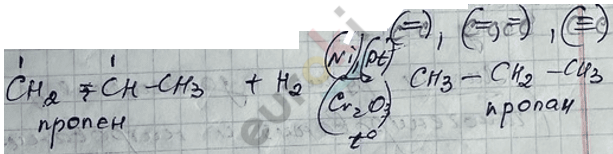
Химические свойства алканов
I. Реакция замещения – основной тип реакции.
1) реакция галогенирования
Условия:


Реакция замещения в сложных УВ-ах идёт по наименее гидрогенизированному атому С.
Механизм реакции замещения у алканов (галогенирования и нитрования) – радикальный или радикально-цепной в 3 стадии:
I стадия
Зарождение цепи


II стадия
Рост или развитие цепи
\(CH_{4}\) + • \(\text{Cl}\) → \(H_{3}C\) • + \(\text{HCl}\)
III стадия
Отрыв цепи
\(H_{3}С\) • + • \(CH_{3}\) → \(CH_{3} - CH_{3}\)
\(H_{3}С\) • + • \(\text{Cl}\) → \(CH_{3} - Cl\)
\(Сl\) • + • \(\text{Cl}\) → \(\text{Cl}_{2}\)
2) реакция нитрования (реакция Коновалова) – радикальный механизм.
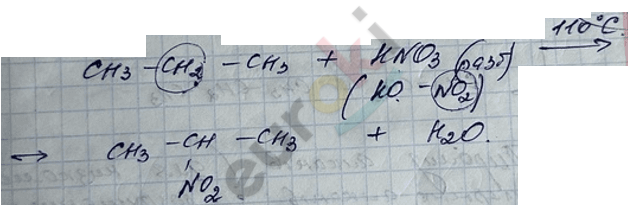
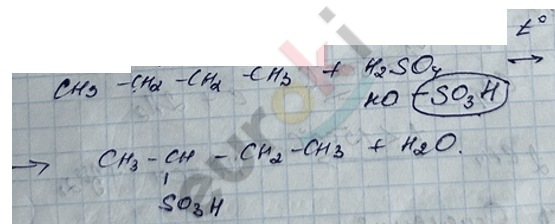
3) реакция сульфирования
II. Реакция изомеризации – превращение линейного алкана в разветвлённый.
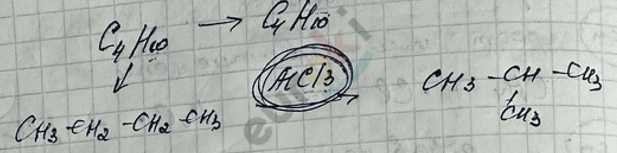
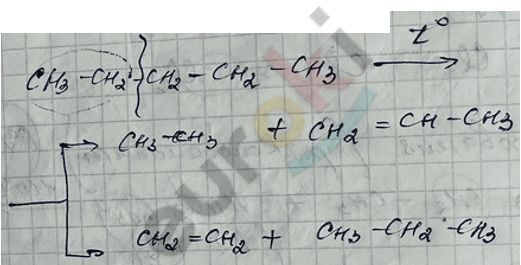
III. Крекинг алканов – разрыв молекулы пополам с получением алкана и алкена одновременно.
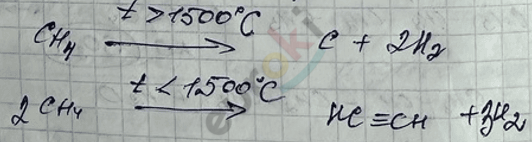
IV. Пиролиз алканов – для низкомолекулярных алканов с разрушением их структуры до простых веществ (\(C\) и \(H_{2}\)).
V. Реакция окисления
1) реакция горения

2) реакция мягкое окисление \(О_{2}\) с kt
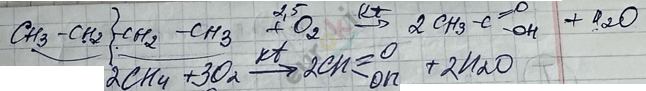
VI. Реакция дегидрирования алканов с получением алкенов.