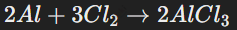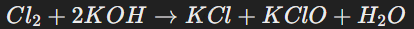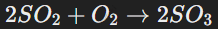Параграф 10 Химия 9 класс Габриелян | Конспект
Строение атомов неметаллов
Неметаллы – это химические элементы, атомы которых содержат 4–7 валентных электронов на внешнем энергетическом уровне. Пример: кислород, углерод.
Для завершения внешней электронной оболочки они либо принимают электроны (окислители), либо обмениваются ими с другими атомами, образуя ковалентные связи (например, молекулы O2, Cl2).
По сравнению с металлами их атомы имеют меньший радиус, поскольку большое число электронов сильнее притягивается ядром.
Неметаллы делятся на типичные неметаллы (водород, углерод, азот, фосфор) и благородные газы, последние обладают завершённой электронной оболочкой и инертны в химических реакциях.
Благородные газы, такие как гелий (He) и неон (Ne), не склонны к образованию соединений благодаря стабильной конфигурации электронов.
Неметаллы расположены в правой верхней части периодической таблицы, исключая водород, который занимает уникальное положение.
Природные формы неметаллов разнообразны: молекулярные газы (O2, H2, N2), жидкость (бром), твёрдые вещества (йод, сера, углерод в виде графита и алмаза).
Физические свойства неметаллов
Неметаллы обладают низкой электропроводностью, так как большинство из них являются диэлектриками. Исключения: графит (высокая электропроводность), кристаллический кремний (полупроводник).
Температуры плавления и кипения неметаллов существенно ниже, чем у металлов. Пример: кислород (−218∘C) и азот (−210∘C) – газы при комнатной температуре.
Окраска неметаллов разнообразна: йод – фиолетовый, сера – жёлтая, бром – бурый. Это связано с особенностями их электронной структуры.
Неметаллы имеют низкую плотность, что делает их легче металлов. Например, водород – самый лёгкий элемент.
Большинство неметаллов не имеют металлического блеска, за исключением кристаллического йода и графита.
Многие неметаллы обладают специфическими агрегатными состояниями. Так, водород и кислород – газы, бром – жидкость, а углерод и сера – твёрдые вещества.
Аллотропные модификации неметаллов, такие как графит и алмаз для углерода, демонстрируют уникальные физические свойства. Пример: графит проводит ток, а алмаз – диэлектрик.
Химические свойства неметаллов
Окислительные свойства
Неметаллы часто выступают окислителями в реакциях с металлами, забирая у них электроны. Пример:
Здесь алюминий отдаёт электроны хлору, образуя соединение AlCl3.
При взаимодействии с металлами неметаллы образуют соединения ионного типа, такие как оксиды и галогениды (MgO, NaCl).
Фтор (F2) – самый сильный окислитель среди неметаллов. Он взаимодействует даже с инертными благородными газами, такими как криптон (Kr).
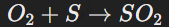
Пример реакции кислорода с серой:
Здесь сера окисляется до степени +4.
Взаимодействие неметаллов друг с другом
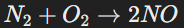
Неметаллы могут взаимодействовать друг с другом, выступая окислителями или восстановителями. Пример: взаимодействие азота и кислорода при высоких температурах:
При этом образуются соединения с ковалентной природой связи, как в случае NO, HCl, CO2.
Восстановительные свойства
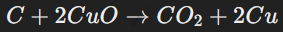
Некоторые неметаллы, такие как водород и углерод, выступают восстановителями. Пример:
Углерод забирает кислород у оксида меди.
В металлургии углерод используется для восстановления металлов из их оксидов (производство железа и меди).
Двойственные свойства
Многие неметаллы могут одновременно выступать как окислители и восстановители, например, хлор в реакции с щелочами:
Здесь образуются продукты с разными степенями окисления хлора.
Окисление сложных веществ
Неметаллы, такие как фтор и кислород, способны окислять сложные вещества. Пример: окисление серы до SO3:
Этот процесс используется в производстве серной кислоты.