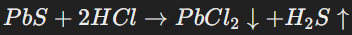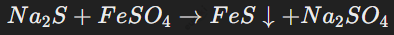Параграф 14 Химия 9 класс Габриелян | Конспект
Сероводород
Восстановительные свойства сероводорода
Сероводород (H2S) имеет минимальную степень окисления серы (-2), благодаря чему выступает в химических реакциях как восстановитель. Он легко отдаёт электроны, участвуя в окислительно-восстановительных процессах. Например, взаимодействие сероводорода с бромной водой приводит к образованию серы:
Нахождение в природе
Сероводород встречается в природе в составе природных и вулканических газов, а также в подземных источниках. Его выбросы могут быть токсичными и загрязнять атмосферу. В природе сероводород окисляется до серы или оксидов серы. Например:
Сероводород в промышленности
В промышленности сероводород применяют для получения серной кислоты и других соединений серы. Например, сероводород горит в избытке кислорода, образуя диоксид серы:
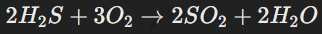
Если кислорода недостаточно, то образуется сера:
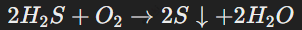
Сульфиды
Образование и свойства сульфидов
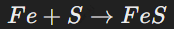
Сульфиды – это соединения серы с металлами, в которых сера проявляет степень окисления -2. Например, при взаимодействии серы с железом образуется сульфид железа:
Восстановительные свойства сульфидов
Сульфиды также обладают восстановительными свойствами. Например, сульфид цинка окисляется до оксида цинка и диоксида серы при нагревании:
Использование сульфидов
Сульфиды широко используются в промышленности. Нерастворимые сульфиды, такие как сульфид свинца (PbS), применяются для получения металлов. Например, в реакциях с кислотами:
Реакции обмена сульфидов
Растворимые сульфиды, такие как сульфид натрия (Na2S), вступают в реакции обмена с солями металлов. Например:
Применение в промышленности
Сульфиды используют в металлургии для извлечения металлов, в полупроводниковых материалах, а также в составе красок и пигментов.