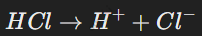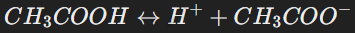Параграф 4 Химия 9 класс Габриелян | Конспект
Электролитическая диссоциация
Электролитами называют вещества, растворы или расплавы которых проводят электрический ток. К ним относятся соли, кислоты и основания. Неэлектролиты (например, сахароза, спирт, глюкоза) не проводят электрический ток, так как не распадаются на ионы. Электропроводность электролитов объясняется распадом вещества на положительные и отрицательные ионы при растворении или плавлении. Эти ионы свободно перемещаются, что и обеспечивает проводимость.
Для изучения электропроводности используют приборы, измеряющие ток в растворе. Пример: лампочка загорается в растворе соли, но не горит в растворе сахара. Электролиты широко применяются в химии, физике и технике, например, в электрохимических процессах.
Причина электропроводности растворов электролитов
Причина электропроводности была впервые объяснена шведским химиком Сванте Аррениусом. Он предположил, что при растворении в воде молекулы электролитов распадаются (диссоциируют) на ионы. Например:
Ионы обеспечивают электропроводность раствора, так как они заряжены и способны переносить электрический ток.
Эта гипотеза получила развитие благодаря работам русских учёных, включая Дмитрия Менделеева, Ивана Каблукова и Владимира Кистяковского. Они подтвердили, что:
Ионы в растворах не свободны, а окружены молекулами воды (гидратированы), что делает их стабильными.
Электролиты распадаются на ионы за счёт взаимодействия с молекулами воды.
Механизм электролитической диссоциации ионных соединений
При растворении ионных соединений, например, соли NaCl, полярные молекулы воды притягивают противоположно заряженные ионы из кристаллической решётки. Это приводит к разрушению кристалла и образованию отдельных ионов. Процесс можно представить уравнением:
Вокруг каждого иона образуется оболочка из молекул воды (гидратация). Это стабилизирует ионы и препятствует их повторному соединению.
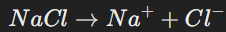
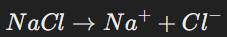
Пример: растворение соли NaCl:
Ионы Na+ и Cl− − притягиваются к молекулам воды.
Кристаллическая решётка разрушается, и ионы становятся свободными.
Механизм диссоциации электролитов молекулярного строения
Электролиты, имеющие ковалентные полярные связи (например, HCl), также могут диссоциировать. При растворении в воде:
Полярная молекула HCl взаимодействует с молекулами воды.
Связь между атомами водорода и хлора разрывается.
Образуются ионы:
Ион H+ соединяется с молекулой воды, образуя гидроксониевый ион H3O+.
Степень электролитической диссоциации
Степень диссоциации (α) показывает, какая часть растворённого вещества распалась на ионы. Формула:
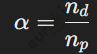
где nd — количество диссоциированных молекул, а np — общее количество растворённых молекул.
Электролиты делятся на:
-
Сильные электролиты (α=1):
Полностью распадаются на ионы.
Примеры: HCl, HNO3, NaOH, K2SO4.
Уравнение: NaOH→Na++OH−.
-
Слабые электролиты (α<1):
Диссоциируют лишь частично.
Примеры: CH3COOH (уксусная кислота), NH3⋅H2O.
Уравнение:
Степень диссоциации зависит от природы вещества, концентрации раствора и температуры. Например, уксусная кислота при разбавлении практически не распадается на ионы, что обусловливает её слабую электропроводность.