Параграф 5 Химия 9 класс Габриелян | Конспект
Основные положения теории электролитической диссоциации
Теория электролитической диссоциации объясняет, почему растворы электролитов проводят электрический ток. Основные положения теории:
Вещества, проводящие электрический ток в растворе или расплаве, называют электролитами, а не проводящие — неэлектролитами.
Электролиты при растворении или плавлении распадаются на положительно и отрицательно заряженные ионы.
Диссоциация электролитов зависит от их химической природы, степени растворения и температуры.
Пример ионов:
Положительные ионы (катионы): Na+, K+, Mg2+.
Отрицательные ионы (анионы):
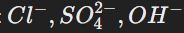 .
.
Ионы двигаются к электродам противоположного заряда, создавая электрический ток. Гидратация ионов (окружение их молекулами воды) делает диссоциацию устойчивой.
Кислоты как электролиты
Кислоты — это электролиты, которые в воде диссоциируют на катионы водорода (H+) и анионы кислотного остатка (Acd−).
Общее уравнение диссоциации кислот:
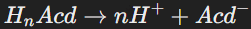
Где n — количество атомов водорода, способных замещаться на катионы металлов.
Примеры:
Одноосновные кислоты: HCl, HNO3.
Двухосновные кислоты: H2SO4.
Трёхосновные кислоты: H3PO4.
Многоосновные кислоты диссоциируют ступенчато. Например:

Кислоты делятся на:
Сильные (полностью диссоциируют): HCl, H2SO4.
Слабые (частично диссоциируют): H2S, CH3COOH.
Основания как электролиты
Основания — это электролиты, диссоциирующие в воде на катионы металлов (Mn+) и гидроксид-ионы (OH−).
Общее уравнение диссоциации оснований:
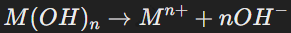
Примеры:
Однокислотные основания: NaOH, LiOH.
Двухкислотные основания: Ca(OH)2, Ba(OH)2.
Основания делятся на:
Сильные (полностью диссоциируют): NaOH, Ba(OH)2.
Слабые (частично диссоциируют): NH3⋅H2O.
Гидроксид аммония:
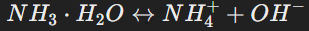
Соли как электролиты
Соли — это электролиты, которые диссоциируют в воде на катионы металлов (или аммония) и анионы кислотных остатков.
Примеры:
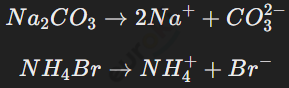
Соли делятся на:
Средние соли — не содержат атомов водорода, заменённых металлом (NaCl, KNO3).
Кислые соли — содержат незамещённые атомы водорода (NaHCO3).
Основные соли — содержат группы OH− (Cu(OH)Cl).
Многоосновные соли (например, NaHCO3) диссоциируют ступенчато:



