Таблица Менделеева | Конспект
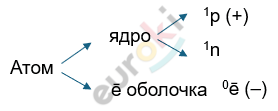
Ar (относительная атомная масса хим. элемента) = массе ядра атома = Z(p) + N(n)
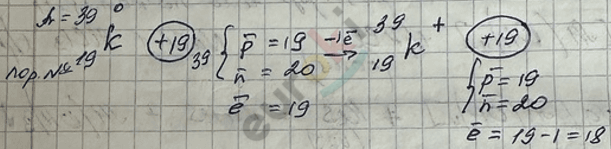

Изотопы – это атомы одного и того же химического элемента, имеющие одинаковый заряд ядра, но разные массовые числа.
Порядковый номер показывает:
- заряд ядра атома;
- число протонов в ядре;
- общее число электронов в атоме.
Номер периода показывает число электронных слоёв (или энергетических уровней) в атоме.
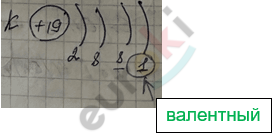
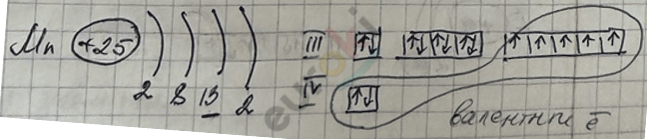
Номер группы показывает:
1) число электронов на внешнем энергетическом (для элементов главных А n/групп);
2) высшую валентность элемента любой n/группы.
Исключение:

У них высшая валентность \(\neq\) номеру группы.
Валентные ē – это:
1) внешние ē (ē последнего энергетического уровня) (для элементов главных А n/групп);
2) сумма внешних sē с пред-внешними d-электронами для d-элементов (элементов побочных n/групп).
У всех d-элементов на внешнем уровне должно быть 2ē.
Исключение:

У них на внешнем уровне остаётся 1sē из-за явления «проскока» электрона.
Принцип наименьшей энергии
1s < 2s < 2p < 3s < 3p < 4s \(\approx\) 3d < 4p < 5s \(\approx\) 4d

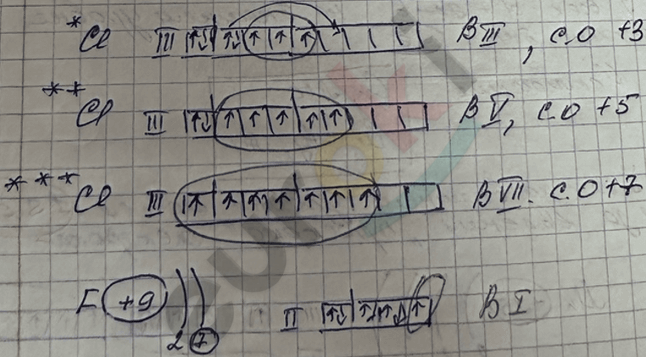
Валентные возможности атомов Cl

Валентность – это число химических связей, которое может образовать данный атом с другими.
Определяется валентность числом неспаренных ē в атоме.
Строение внешней электронной оболочки, аналогичной Ar, будет у ионов:
1) 4 элемента до Ar в ионизированном виде: \(\text{Cl}^{-}\), \(S^{2 -}\), \(P^{3 -}\), \(\text{Si}^{4 -}\) – анионы;
2) 2 элемента после Ar в ионизированном виде: \(K^{+}\), \({Ca}^{2 +}\) – катионы.

Летучие водородные соединения характерны для неметаллов с IV по VII группы A n/групп.
Число атомов водорода определяется формулой: 8 – № группы.

Кислотные свойства усиливаются, основные – ослабляются.

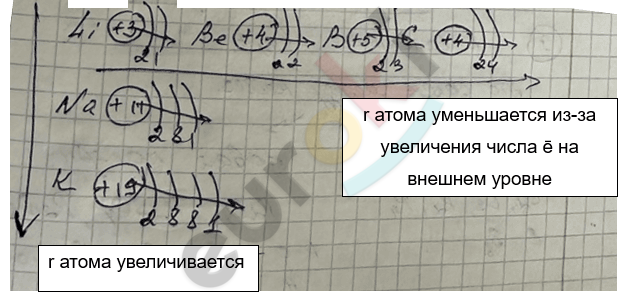
Радиус атома увеличивается => длина связи увеличивается => прочность связи уменьшается.
Постоянная СО у щелочных металлов +1, у щёлочноземельных, Be, Mg +2.
\(\text{In}^{+ 2}\), \(\text{Al}^{+ 3}\), \(F^{- 1}\)


